特别注意:取材时尽量精确到需要观察的目的部位(如观察肾小球取肾皮质;观察胰岛取胰岛丰富的胰尾;皮肤,肠胃等在固定液中易打卷的组织可将组织粘在滤纸上进行固定)。
(3)打印填写完整的预约单或送样单和样品一起寄送;
(4)不做磁性样本。

项目推荐
项目介绍
样品要求
结果展示
常见问题
 预约须知
预约须知
1.样本要求:仅接收2.5%戊二醛固定液固定后的生物样品
(1)细胞样品:用1.5ml的尖底管,离心成团(至少绿豆大小),加入新鲜的固定液(固定液加满离心管,使样品完全浸没在固定液中,建议加完固定液之后重悬下,让样本与固定液充分接触),放置于4°C固定12h后,用泡沫盒加冰袋低温保存运输。 (细菌样品要求同细胞)
(2)组织样本:新鲜取材后,取1mm³立方体小块使用2mL离心管加满新鲜的2.5%戊二醛固定液,放置于4°C固定12h后,用泡沫盒加冰袋低温保存运输。注意:样本管与冰袋隔开,避免固定液结冰。固定液渗透能力有限,超出此范围后组织会无法完全固定,后续实验无法完成,请务必重视此过程。
特别注意:取材时尽量精确到需要观察的目的部位(如观察肾小球取肾皮质;观察胰岛取胰岛丰富的胰尾;皮肤,肠胃等在固定液中易打卷的组织可将组织粘在滤纸上进行固定)。
(3)打印填写完整的预约单或送样单和样品一起寄送;
(4)不做磁性样本。
2. 特别注意:是否需要包埋、切片或者负染;形貌拍摄由于其特殊性,老师会尽力拍摄,但无法保证一定会拍到您预期效果的图片,敬请理解!
3.不接收含有坚硬材料的样本,客户需对样品信息的真实性负责,若故意有所隐瞒,在测试过程中对设备造成损坏等一切后果将由您全部承担!
4. 提供10张拍摄照片(不提供分析服务),如需照片数量超过10张,按照30元/张收费请悉知!如有其他疑问,请联系前期对接的技术顾问。
展开全部收起
 项目介绍
项目介绍
生物透射电镜是观察生物细胞样品内部形态的重要工具,其电压在80-120kv可以降低生物样品因高能电子束辐射而损伤的影响,同时依赖于生物样品制备技术的发展,如超薄切片技术、负染色技术、冷冻制样技术、细胞化学技术等,广泛应用于组织学、细胞学、病毒学、病理学及材料学等多个学科的研究中,一般用来观察细胞整体结构、细胞膜细胞壁细胞器的变化、材料进入细胞内部的分布情况或者细胞应付外界刺激产生的自噬小体等结构,以及外界生物入侵的侵染结构等等。
 样品要求
样品要求
1. 细胞样品:用1.5ml的尖底管,离心成团(至少绿豆大小),加入新鲜的2.5%戊二醛固定液(固定液加满离心管,使样品完全浸没在固定液中,建议加完固定液之后重悬下,让样本与固定液充分接触),放置于4°C固定12h后,用泡沫盒加冰袋低温保存运输,注意:样本管与冰袋隔开,固定液切勿冷冻结冰。 (细菌样品要求同细胞)
2. 组织样本:肠、血管、皮肤、肌肉等有方向性样本需切成1mm*3mm*0.5mm长方体小块(如下图B),要观察的面为横切面(1mm*0.5mm),使用2mL离心管加满2.5%戊二醛固定液;无方向性的组织,如肝脏、肾脏、肺脏等可切成1mm³立方体小块(如下图A),使用2mL离心管加满2.5%戊二醛固定液,放置于4°C固定12h后,用泡沫盒加冰袋低温保存运输。注意:样本管与冰袋隔开,避免固定液结冰。固定液渗透能力有限,超出此范围后组织会无法完全固定,后续实验无法完成,请务必重视此过程。
特别注意:取材时尽量精确到需要观察的目的部位(如观察肾小球取肾皮质;观察胰岛取胰岛丰富的胰尾;皮肤,肠胃等在固定液中易打卷的组织可将组织粘在滤纸上进行固定)。
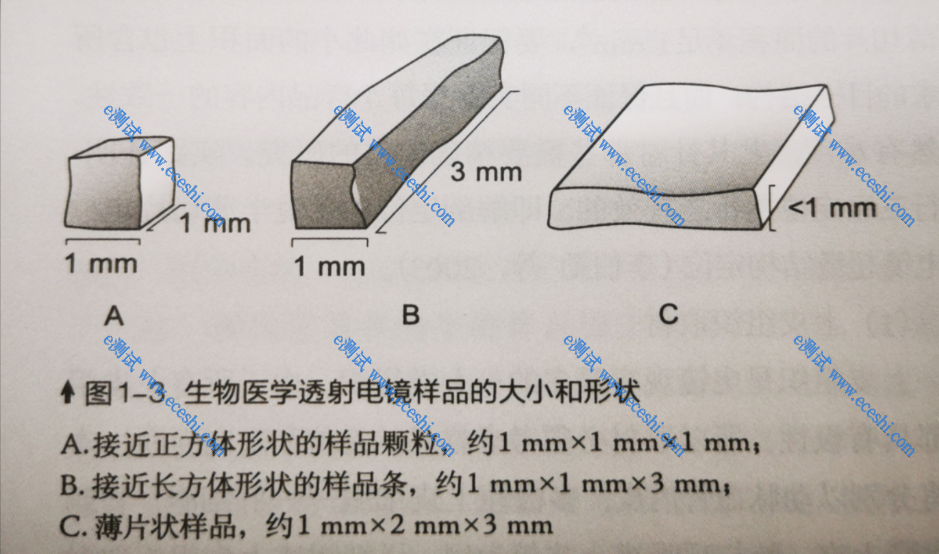
图1:电镜样本的大小和形状(《生命科学中的电子显微镜技术》)
3. 植物样本:取材流程:PBS冲洗样品,确保无泥沙等污染物。然后用锋利刀片或剪刀将样品切成合适大小,装入预冷的植物及细菌电镜专用2.5%戊二醛中。不需要定位的样品切成1立方毫米大小(如叶片、果实、花粉等),需要定位的样品,切1mm×3mm×0.5mm的长条状(茎、根、表皮等)随后抽气,让组织能沉淀到管底。充分固定后,用泡沫盒加冰袋低温保存运输,注意:样本管与冰袋隔开,固定液切勿冷冻结冰。
具体取材流程参考:
(一)动物组织取材流程及要求
取材是电镜实验的第一步,其操作成功与否直接关系到电镜结果的效果及成败。为了得到好的结果,请务必按要求做好取材!取材基本要点:快(1min)、冷(4℃)、小(1 mm3)、净(无杂质)、准(部位准确)。不同的样品,取材细节上有很大区别!
取材流程:动物麻醉或断头急性处死,解剖取出所需的器官或组织,生理盐水简单冲洗血液及组织液。按要求将组织切成1mm³左右小块,固定于组织及细胞电镜专用2.5%戊二醛固定液中。
固定方式有两种:
a: 浸泡固定:适用于一些能允许在短时间内停止供血而仍保持其功能和结构的器官或组织,以及一些病理检查的样品。其方法是经解剖 (或手术)尽快从机体中取出所需组织,并按取材要求,把组织切成小块,放入小瓶子内作常规固定。
b: 血管灌注固定:适用于取材较复杂或对缺氧较敏感的器官或组织,须采用血管灌注固定。灌注固定一般通过供血的动脉进行,小动物也可经左心室或升主动脉穿刺,行全身灌注。可根据动物的大小选用全身灌注或局部灌注的方式。参考方法:首先用50毫升生理盐水(37℃)清洗血液,接着用50毫升多聚甲醛固定液(37℃)快速灌注固定,然后用250-300毫升冷固定液(4℃)慢速灌入,持续10-15分钟后取材,置组织于戊二醛固定液中,在4℃冰箱中固定。
具体取材要求:
(1)位置:肝、肺、脾等无需定位组织取1mm³组织,3-5块;需要定位组织如骨骼肌、肾、肠、血管、胰岛等组织取材大小为0.5mm×1mm×3mm左右的长条状,且保证观察结构在组织块中。
(2)操作:试剂、容器、器械提前4℃预冷;组织离体后,1min内浸入戊二醛固定液。取材时,可提前准备一个载玻片(硬卡纸),滴几滴戊二醛固定液,把标本浸在液滴中修整至合适大小(时间可稍长),用牙签挑出3~5粒标本,放入1.5ml尖头EP管。将修整好的标本块放入戊二醛固定液后,普通4℃冰箱保存。
(二)细胞取材流程及要求
对于细胞、细菌样本取材,取好后需放入1.5ml离心管中(尖底),黄豆大或者绿豆大,根据细胞培养类型不同,取材方式不同:
1、悬浮细胞:轻微并短暂离心培养液后收集细胞,加入新鲜缓冲液,低温1000rpm/min(离心力不可过大,离心时间不可过长,避免机械挤压导致细胞变形,也可根据具体情况调整)离心5min,弃上清。滴加新鲜缓冲液重悬几分钟,低温1000rpm/min,离心5min,青弃上清,重复2遍。样品加入新鲜的2.5%戊二醛固定液后重悬,4℃固定过夜。
收集细胞要肉眼可见细胞沉淀有绿豆大小,弃培养基后加电镜固定液4度避光固定24h,4°冰袋运输,在保存和运输过程中固定液切勿冷冻结冰。敏感的细胞直接固定,不洗。
2、贴壁细胞:采用轻吹,刮刀;若用胰酶消化0.5min后立即加入血清终止(贴壁牢的肿瘤细胞,可以消化+刮刀),置于尖底1.5mL离心管中,滴加1小滴固定液立即混匀(勿使液体凝固),低温1000rpm/min离心5-10min,弃上清(不清洗)。收集绿豆大小的细胞沉淀置于尖底1.5mL离心管中。沿管壁小心加满4℃预冷新鲜的2.5%戊二醛固定液(固定液加满离心管,使样品完全浸没在固定液中,建议加完固定液之后重悬下,让样本与固定液充分接触),放置于4°C固定12h后,用泡沫盒加冰袋低温保存运输,注意:样本管与冰袋隔开,固定液切勿冷冻结冰。
3、细菌:吸取OD0.5-0.8的培养物,离心后弃培养基,收集菌体沉淀于管底绿豆大小,可以用PBS洗1-2次,弃掉上清液,沿管壁缓慢加入4℃预冷的固定液(固定液加满离心管,使样品完全浸没在固定液中),放置于4°C固定12h后,用泡沫盒加冰袋低温保存运输,注意:样本管与冰袋隔开,固定液切勿冷冻结冰。
4、固体培养
从培养基上刮取细胞群落,加入新鲜缓冲液,低温1000rpm/min离心5min后,弃上清。滴加新鲜缓冲液重悬15min,低温1000rpm/min离心5min,弃上清,重复2遍。样品加入戊二醛固定液后重悬,4℃固定过夜。
注意事项:
(1)细胞数量充足(10cm皿长满),离心后在EP管中黄豆大小;
(2)缓冲液、戊二醛固定液等PH值7.3-7.4,4℃提前预冷;
(3)贴壁细胞连着培养基用细胞刮斜着快速刮下,不要反复来回刮;
(4)细胞悬液转入离心管,1000-3000rpm离心成团,弃上清,加PBS,将细胞转入1.5mL尖头EP管,再次离心后弃上清。再加PBS重复上述步骤,最后加2.5%戊二醛固定,4℃保存。操作轻柔,固定液加满离心管,使样品完全浸没在固定液中,建议加完固定液之后重悬下,让样本与固定液充分接触。(转速及时间请结合细胞情况,尽量低转速、短时间,以细胞离心成团为准!(PBS 清洗时间过长,易造成细胞损伤);
(三)植物组织取材及要求
取材流程:PBS冲洗样品,确保无泥沙等污染物。然后用锋利刀片或剪刀将样品切成合适大小,装入预冷的植物及细菌电镜专用2.5%戊二醛中。不需要定位的样品切成1立方毫米大小(如叶片、果实、花粉等),需要定位的样品,切成1mm×3mm×0.5mm的长条状(茎、根、表皮等)随后抽气,让组织能沉淀到管底。
注意事项:植物细胞的细胞壁和液泡会阻碍固定液迅速渗入。植物材料内部存有的空气,往往使材料漂浮于固定液面之上,由此影响到植物组织的固定效果。组织放入戊二醛固定液后,可用真空泵或者50ml的注射器抽出组织内部的气体或者用滤纸压住叶片,使材料沉入固定液中。简易抽气方法:将植物组织同固定液一起倒入注射器,用乳胶手套食指堵住注射器出口,右手拉动针栓,将注射器口垂直向上,松开食指,右手轻推针栓使液面上的气泡从注射器口排出,反复多次,直至组织沉入固定液。
友情提示:由于样本的复杂性,上述为通用建议,请您根据样品情况酌情选择合适的处理方式。
 结果展示
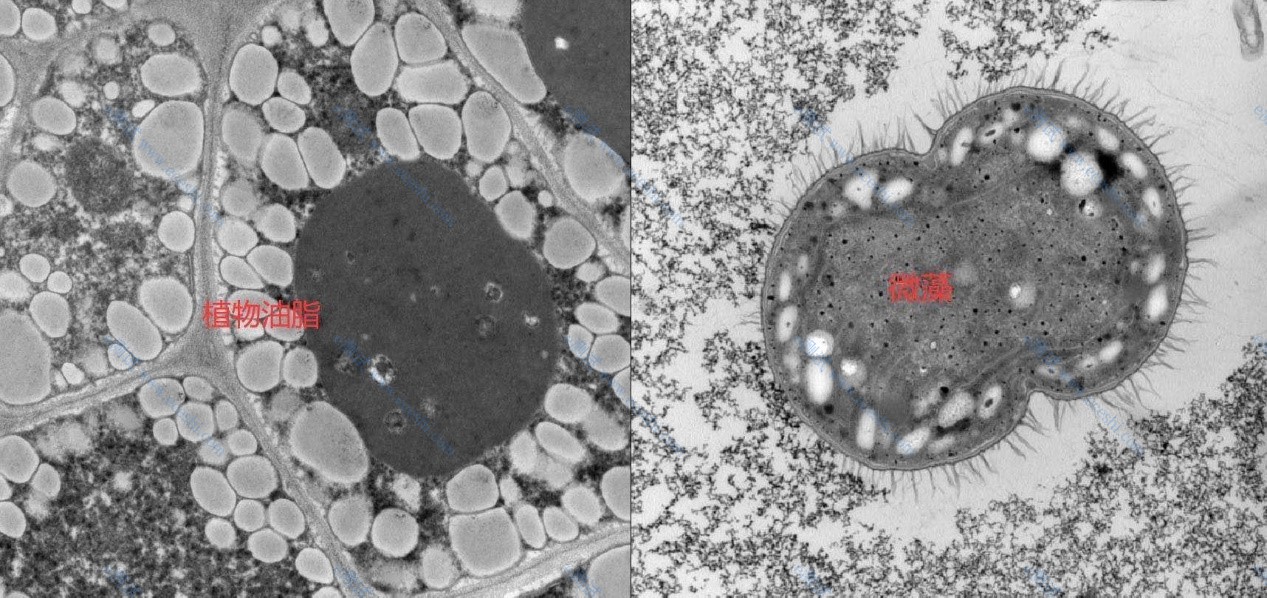
结果展示
参考图:


 常见问题
常见问题
 植物的根部为什么有时看不到细胞核?
植物的根部为什么有时看不到细胞核?
植物细胞的细胞核相对比较小,不好切,切片的时候有可能没有切到,所以在观察透射电镜的时候会发现看不到细胞核。
 切片染色的目的是什么?
切片染色的目的是什么?
由于生物样品主要由碳、氢、氧、氮等轻元素组成。这些元素原子对电子的散射能力很弱,相互之间的差别也很小。尤其生物超薄切片被树脂所包埋,这些包埋树脂对电子的散射能力与样品本身差别很小。因此生物样品超薄切片观察时像的反差极弱。为了提高图像的反差,要对超薄切片进行电子染色。这里所谓电子染色是根本不同于光学显微镜的染色,它是利用重金属盐(如铅盐、铀盐等)与细胞的某些成分或结构结合,由于重金属对电子散射能力很强,使那些与其结合的结构或成份对电子散射能力增强,从而达到提高样品本身反差的。目前最常用的染色剂是醋酸铀和柠檬酸铅染色液。
 2.5%戊二醛固定液如何配置?
2.5%戊二醛固定液如何配置?
市售25%戊二醛水溶液 10ml
0.2M磷酸盐缓冲液(pH7.0) 50ml
蒸馏水加至 100ml

400-630-1090
推荐文章
2024-07-04 0 2807
2024-07-04 0 2667
2024-03-01 0 883